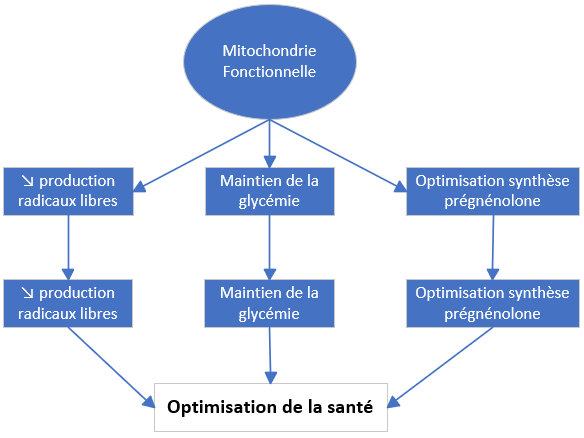
G – Mitochondrie
Mitochondrie et stéroïdogenèse
- Mitochondrie : lieu de synthèse de la prégnénolone – précurseur de toutes les H. stéroïdes
- Précurseur de la prégnénolone → Cholestérol
- Protéine STAR: entrée du cholestérol dans la mitochondrie
- Stéroïdogenèse > facteurs limitants :
- Mitochondries fonctionnelles
- Taux de cholestérol suffisant
- Protéines STAR actives (T3)
Vieillissement
Les micronutriments mitochondriaux
| B1 et Acide alpha lipoïque | Entrée du pyruvate dans la mitochondrie |
| Fer | Nécessaire aux 2 premiers moulins à proton |
| Cuivre | Nécessaire au 3ème moulin à proton |
| Vit B2 | Précurseur du transporteur d’électron FAD |
| Vit B3 | Précurseur du transporteur d’électron NAD |
| Vit B5 | Précurseur du Coenzyme A |
| CoQ10 | Transport électrons du 1er au 2e moulin à proton |
| Magnésium | Hydrolyse de l’ATP en ADP Phosphorylation de l’ADP en ATP Glycolyse |
| L-carnitine | Entrée des acides gras dans la mitochondrie |
| Oméga 3 DHA | Membrane interne mitochondriale |
| Antioxydants | Neutraliser les radicaux libres produits |
CoQ10
| Liposoluble | |
| Rôle mitochondrial | Antioxydant Transporteur électrons ds la chaîne respiratoire Synthèse énergétique mitochondrial Protecteur cardiovasculaire |
| Forte concentration dans les organes énergivores | Cœur, rein, cerveau |
| Origine | Apport alimentaire et synthèse endogène À partir de l’acétyl CoA (Vit B5) Par la voie de synthèse du cholestérol (attention statines !) |
| Aliments sources | Poissons gras – Bœuf – Noix – Huiles végétales |
| En complément | 30 à 200 mg 30 à 100 mg qd statine Forme liposoluble : mieux absorbée dans les autres situations Forme hydrosoluble : À prendre au cours d’un repas |
Acide alpha lipoïque
| Rôles |
|
| Complément |
|
L-Carnitine
| Rôle | Transporteur ac. gras > 10 C dans la mitochondrie |
| Origine | 75% Alimentaire Prot. animales (viande rouge++ du type agneau, gibier, bœuf; fromage de chèvre) 25% Synthèse endogène |
| Synthèse endogène | À partir des a.a lysine et méthionine / Méthylation (Vit B2 – B9 – B12, B6 zinc) B12 : protéines animales Enzyme MTHFR + polymorphisme génétique++ |
| Population à risque de carence | Végétarien : pas d’apport ni de synthèse ! Végétalien Déficit de B2-B9-B12 ou de Polymorphisme MTHFR |
| Avant administration | Dosage TMAO Microbiotes TMAO : génère synthèse de TMA à partir de la L-carnitine (et choline). Oxydé en TMAO par le foie. TMAO= marqueur de risque cardio-vasculaire ? TMAO élevé, traiter la dysbiose, puis recontrôler le TMAO. |
Oméga 3
| Rôle dans la mitochondrie |
|
| Constat | Optimisation de l’index oméga 3 = Augmentation du rendement mitochondrial |
| Dans l’assiette | ALA : 3 cas d’huile colza/lin/cameline/J EPA-DHA+++ : 300g de poissons gras/sem |
| En complément | EPA-DHA : 500- 1000 mg d’huile de poisson/jour (le soir) |
Vit B3 – NAD
| Synthèse Vit B3 | Hépatique. À partir du tryptophane (en concurrence avec synthèse de sérotonine) |
| Synthèse NAD | À partir de B3 (B3= précurseur NAD) NAD(oxydé)/NADH(réduit) → NAD/NADH : Activation des sirtuines → biogenèse mitochondriale |
| Rôles NAD/NADH | NAD= transporteur électrons (et protons) dans la mitochondrie Métabolisme : Glycolyse-Chaine de phosphorylation Détoxication (Phase 1) Activité des SIRT (NAD= cofacteur SIRT et activité dépendant rapport NAD/NADH) Anti oxydant : recycle GSH et ac α lipoïque |
| En complément | Nicotinamide : 200-300mg/J |
Cofacteurs mitochondriaux et sources alimentaires
| Cofacteurs | Sources alimentaires |
|---|---|
| Vit. B1 | Levures alimentaires, germe de blé, céréales complètes |
| Vit. B5 | Champignons shiitake, abats, son de céréales, œufs |
| Vit. B3 | Avocats, brocolis, amandes, champignons, épinards |
| Vit. B2 | Céréales complètes, fromage, levures de bière, abats |
| Magnésium | Céréales complètes, légumineuses, légumes verts, oléagineux, poisson gras |
| L-carnitine | Viande (rouge++), abats, produit laitier |
| CoQ10 | Poisson gras, volaille, bœuf, graines oléagineux, crucifères |
| DHA | Poisson gras |
| Cuivre | Abats, fruits de mer, chocolat noir |
| Fer | Viandes, abats, poisson, fruits de mer |
Biogénèse mitochondriale
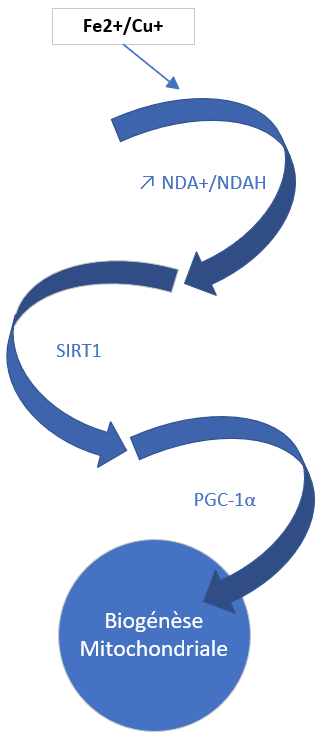
SIRT 1 et biogénèse mitochondriale
| Qu’est ce que la Sirt 1 ? | Effet de l’activation Sirt 1 | Quels sont les activateurs des sirt1 ? |
|---|---|---|
|
|
|
Quelle intensité pour optimiser la biogénèse mitochondriale?
- Marqueur fonctionnelle de la biogénèse mitochondriale = PGC1 alpha
- Endurance et HIIT : augmentation de PGC1alpha identique
- Mais : Temps d’entrainement largement inférieur pour le HIIT
Activité physique > Active la Sirt 1 > ↑ biogénèse mitochondriale
Biogénèse mitochondriale : conditions
« Vider les camions » > 2 solutions :
- On arrête de les remplir : Restriction calorique -> moins de remplissage de camion
- On accélère le déchargement : Activité physique -> décharge ++ le camion
Fonctionne que si suffisamment de camions
- Camion vide : NADH
- Camion plein : NAD+
- NAD : Récupère les électrons au niveau du cycle de Krebs et les transfère aux pompe à proton pour synthèse d’ATP
- Précurseur NAD = Vitamine B3
NAD = Nicotinamide Adénine Dinucléotide
NAD et mitochondrie
- Transporteur d’électron dans la mitochondrie
- Cofacteur de la Sirt1
- NAD/NADH : activation Sirt1
Forme oxydée : NAD+ (sans électrons)
Forme réduite : NAD+H+ (avec électrons)
Activation de la SIRT 1 = Biogénése mitochondriale
NAD+/NADH
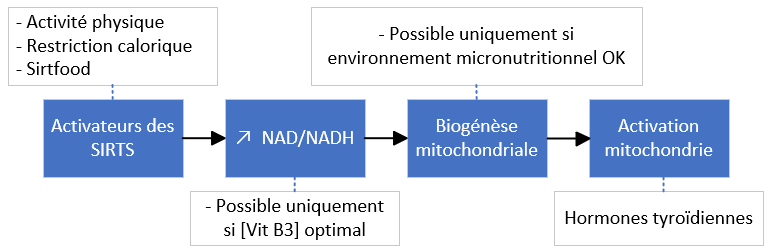
- Restriction calorique
- Activité physique
- Suffisamment de vit B3
Possible si et seulement si tous les micronutriments mitochondriaux sont présents
Recommandation : Alimentation à forte densité micronutritionnelle +++
Restriction calorique
RC mode d’emploi :
- à 30 % ses apports alimentaires
- Favoriser les aliments à forte densité micronutritionnelle
- Inefficace en cas de carence micronutritionnelle (Notamment Vit B3)
Régimes hypocaloriques, peuvent conduire à des déficit micronutritionnels
- Biogénèse mitochondriale
- hormones thyroïdiennes
Jeûne circadien (le soir++) = bon modèle.
Activité physique et Biogénèse mitochondriale
- Activité physique NAD/NADH Biogénèse mitochondriale
- Si pas de déficit de B3
- Déficit B3 : NAD/NADH
Biogénèse mitochondriale : Quel type d’activité physique?
PGC1α en fonction de l’intensité
- PGC1α= marqueur fonctionnel de la biogénèse mitochondriale
- Endurance et HIIT : augmentation de PGC1α identique
- Mais: Temps d’entraînement largement inférieur pour le HIIT
- Rameneé au temps : Le HIIT est plus efficace que l’endurance pour induire la biogénèse mitochondriale
Sirtfood : Le resvératrol
| Rôles | Antioxydant Lipo ET hydrosoluble :
|
| Complément |
|
Sirtfood : Vit. B-NAD
| Synthèse NAD | À partir de B3 (B3= précurseur NAD) |
| NAD (oxydé) / NADH (réduit) |
|
| Rôles NAD-NADH |
|
| En complément |
|
Double membrane
- Membrane interne : origine bactérienne
- Protéines de la chaîne respiratoire :
- 3 Pompes à proton (Complexe 1-3-4) et complexe 2
- ATP synthase
- Pas de Cholestérol
- Richesse en DHA+++
- Protéines de la chaîne respiratoire :
- Membrane externe : similaire à la membrane cellulaire (provient du phagosome de la cellule eucaryote)
Mitochondries : Rôles
- Synthèse énergétique (50 kg d’ATP par jour !)
- Production de chaleur (Tissus adipeux brun)
- Mort cellulaire programmée
- Production des hormones stéroïdes
- Contrôle de la concentration de Calcium intracellulaire
- Élimination de l’ammoniac sous forme d’urée
- Production des hormones stéroïdes → « vers a signal »