Méthylation
La méthylation est une modification biochimique clé dans les processus cellulaires, consistant en l’ajout d’un groupe méthyle (CH₃) à une molécule, généralement à l’ADN, aux protéines ou aux autres biomolécules. Ce processus est essentiel pour la régulation de l’expression génique, le métabolisme des nutriments, la détoxification, et la stabilité des génomes. En médecine, en micronutrition et en nutrithérapie, la méthylation joue un rôle crucial dans des fonctions physiologiques, et son dysfonctionnement est associé à plusieurs maladies chroniques, telles que le cancer, les troubles neurologiques, et les maladies cardiovasculaires.
Principes de la méthylation
- Méthylation de l’ADN :
- La méthylation de l’ADN se produit principalement au niveau des cytosines dans des régions riches en dinucléotides CpG (îlots CpG). Cette méthylation est catalysée par des enzymes appelées ADN méthyltransférases (DNMTs), qui ajoutent un groupe méthyle au carbone 5 de la cytosine, formant la 5-méthylcytosine.
- La méthylation de l’ADN est un mécanisme central de la régulation de l’expression des gènes. Elle peut inhiber la transcription des gènes en modifiant la structure de la chromatine, rendant l’ADN moins accessible aux facteurs de transcription. Ce processus est important pour la répression des gènes et le silencing génique.
- Méthylation des protéines et des ARN :
- La méthylation des protéines concerne principalement les histones, des protéines autour desquelles l’ADN s’enroule pour former la chromatine. La méthylation des histones (en particulier sur les lysines et arginines) régule la structure de la chromatine et l’expression génique.
- La méthylation des ARN (notamment l’ARN messager, ARNm) influence leur stabilité, leur transport et leur traduction, affectant ainsi la régulation post-transcriptionnelle des gènes.
- Donneurs de groupes méthyle :
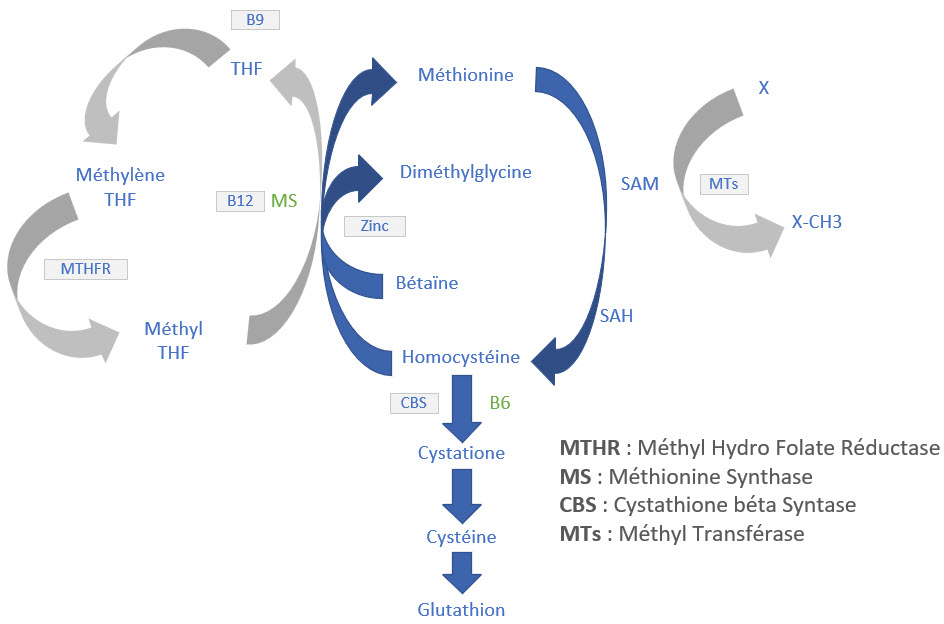
- Le principal donneur de groupes méthyle dans les réactions de méthylation est la S-adénosylméthionine (SAM), dérivée de la méthionine. La SAM transfère son groupe méthyle à l’ADN, aux protéines, ou aux autres molécules dans des réactions catalysées par des méthyltransférases.
- Le cycle de la méthylation est étroitement lié au cycle de l’homocystéine et dépend de vitamines B (B12, B6, et folates) pour la régénération de la méthionine à partir de l’homocystéine via la méthionine synthase.
Rôles biologiques de la méthylation
- Régulation de l’expression génique :
- La méthylation de l’ADN est un mécanisme épigénétique clé qui régule l’expression des gènes sans modifier la séquence d’ADN. Une méthylation excessive peut réprimer des gènes importants comme les gènes suppressifs de tumeurs, contribuant au développement du cancer, tandis que l’hypométhylation peut réactiver des gènes oncogènes.
- Réparation de l’ADN et stabilité du génome :
- La méthylation est cruciale pour la réparation de l’ADN et la stabilité génomique, notamment en régulant l’activité des éléments transposables, qui peuvent endommager le génome s’ils ne sont pas contrôlés.
- Métabolisme et détoxification :
- La méthylation intervient dans la détoxification des toxines et des xénobiotiques, ainsi que dans le métabolisme de nombreux composés biochimiques tels que les hormones et les neurotransmetteurs. Par exemple, la méthylation permet la conversion de la noradrénaline en adrénaline.
- Cycle de l’homocystéine et santé cardiovasculaire :
- La méthylation recycle l’homocystéine en méthionine. Une accumulation d’homocystéine en raison d’une méthylation inefficace est un facteur de risque pour les maladies cardiovasculaires et les troubles neurologiques.
Dysfonctionnements de la méthylation et pathologies associées
- Hyperhomocystéinémie :
- Une méthylation insuffisante peut entraîner une accumulation d’homocystéine, augmentant le risque de maladies cardiovasculaires et de troubles neurodégénératifs.
- Troubles neuropsychiatriques :
- Les anomalies dans le cycle de la méthylation affectent la production de neurotransmetteurs, contribuant à des troubles comme la dépression, la schizophrénie, et l’autisme.
- Maladies auto-immunes et cancers :
- Des altérations épigénétiques, telles que l’hyperméthylation des gènes suppressifs de tumeurs, favorisent le développement de cancers. À l’inverse, l’hypométhylation peut réactiver des gènes oncogènes.
- Problèmes liés à la grossesse :
- Une méthylation déficiente peut entraîner des complications telles que des défauts du tube neural chez le fœtus, souvent liés à une carence en folates.
Nutriments clés dans le cycle de la méthylation
- Folate (vitamine B9) :
- Le folate est essentiel à la conversion de l’homocystéine en méthionine, grâce à la méthionine synthase. Les mutations du gène MTHFR peuvent altérer cette conversion.
- Vitamine B12 (cobalamine) :
- La vitamine B12 est un cofacteur indispensable pour la méthionine synthase. Une carence en B12 perturbe le cycle de la méthylation, augmentant l’homocystéine.
- Vitamine B6 (pyridoxine) :
- La vitamine B6 intervient dans la conversion de l’homocystéine en cystéine, facilitant l’élimination de l’excès d’homocystéine par la voie de la transsulfuration.
- Bétaïne (triméthylglycine) :
- La bétaïne est un donneur de groupe méthyle alternatif qui aide à réduire l’homocystéine, soutenant ainsi la régénération de la méthionine.
- Méthionine et S-adénosylméthionine (SAM) :
- La S-adénosylméthionine (SAM), dérivée de la méthionine, est le principal donneur de groupes méthyle dans le corps, nécessaire pour la méthylation de l’ADN, des protéines, et des lipides.
Optimisation de la méthylation en micronutrition
- Soutien du cycle de la méthylation :
- Un apport suffisant en vitamines B (B12, B9, B6) et en bétaïne est essentiel pour maintenir un cycle de méthylation efficace et prévenir des problèmes liés à l’accumulation d’homocystéine.
- Gestion de l’homocystéine :
- Des tests sanguins pour mesurer les niveaux d’homocystéine peuvent aider à détecter un dysfonctionnement du cycle de la méthylation et orienter une supplémentation en folates, B12, et B6 pour réduire les risques de maladies cardiovasculaires et neurologiques.
- Évaluation génétique (MTHFR) :
- Le dépistage des mutations du gène MTHFR est recommandé pour les personnes ayant des antécédents familiaux de troubles cardiovasculaires ou neuropsychiatriques, afin de personnaliser les apports en folates et en vitamine B12.
- Alimentation et suppléments :
- Une alimentation riche en légumes à feuilles vertes (source de folates), en viandes et poissons (source de vitamine B12), et en grains entiers et noix (source de bétaïne et de vitamine B6) est nécessaire pour un soutien optimal du cycle de la méthylation.
Conclusion
La méthylation est un processus essentiel pour la régulation épigénétique, le métabolisme des nutriments, et la détoxification. En micronutrition, le soutien du cycle de la méthylation à travers un apport optimal en vitamines B, en bétaïne, et en S-adénosylméthionine est crucial pour prévenir des maladies cardiovasculaires, neuropsychiatriques, et métaboliques, tout en favorisant un métabolisme cellulaire sain.
Rappels sur la méthylation
Rappels
- Transférer un groupement méthyl (CH3) à une molécule.
- Processus indispensable pour de nombreuses fonctions :
- Détoxication
- Expression des gènes
- Synthèse de L-carnitine, Créatine, Phosphatidylcholine
- Synthèse de Neurotransmetteurs
- Voie secondaire de dégradation histamine
Méthylation
Méthylation et fonction Neuropsychique
- Méthylation de la Noradrénaline → Adrénaline
- Méthylation surconsommée en cas de stress
- Méthylation de la sérotonine en Mélatonine
- Synthèse de phosphatidylcholine (lécithine)
- Fluidité membranaire
- Synthèse de L-carnitine :
- Stabilisant membranaire :
- Facilite la neurotransmission
- Fonction mitochondriale
- Activité des COMT
- Dégradation des catécholamines
- SAM :
- = S-Adénosyl-méthionine
- Principal donneur de méthyl
- Devient SAH puis Homocystéine après transfert CH3
- Reméthylation de l’homocystéine : Les 3 intervenantes
- B9 Méthylée sous forme de Méthyl tétra hydro folate
- B12 Méthylée : Méthylcobalamine
- Bétaine = Tri méthyl Glycine